qPCR標準曲線:獲得優質qPCR數據的關鍵

乍一看,qPCR看起來是一個非常簡單的技術,當它得到優化時,它可以帶來偉大的結果。
然而,為了獲得一致和準確的結果,反映你的樣本中真正發生了什麼,良好的對照對良好的qPCR數據至關重要。
這些關鍵控製之一是qPCR標準曲線。這使你能夠檢查引物的效率。
高效引物對獲得高質量的qPCR數據很重要
設計和測試qPCR引物在做任何qPCR實驗之前,使用標準曲線是絕對必須的!確保獲得的Ct值是有價值的,並反映現實是很重要的。
在你收到新的引物後,你通常會不耐煩地運行你的qPCR以獲得新的結果。但如果你不先測試引物,那麼你可能會得到錯誤的結果,並損失大量時間。沒有研究人員願意冒這個險。
無論你是用生物信息學軟件設計引物,來Bitesiz188bet手机版APPe Bio尋求幫助,或者選擇一個已經發表的序列,你不能保證你的引物是好的。即使熔體曲線的結果是一個漂亮的,幹淨的單峰,這並不表明寡聚物是可用的。在劑量依賴性DNA擴增過程中,它們仍然可能無法有效地擴增靶標。
因此,您應該始終用qPCR標準曲線檢測引物。qPCR標準曲線確保引物與目標物有效而精確地結合並擴增,這是至關重要的。
如何繪製qPCR標準曲線
要執行qPCR標準曲線,你需要建立qPCR反應來擴增不同數量的相同DNA樣本。從理論上講,有效的引物會產生成比例的劑量-反應曲線。
要得到一個好的標準曲線,理想情況下至少需要幾個數量級(5- 10倍稀釋)的5個數據點。
然後,你需要在y軸上繪製得到的Ct值,在x軸上繪製每毫升的log DNA拷貝數。一個標準曲線的例子如下麵的圖1所示。
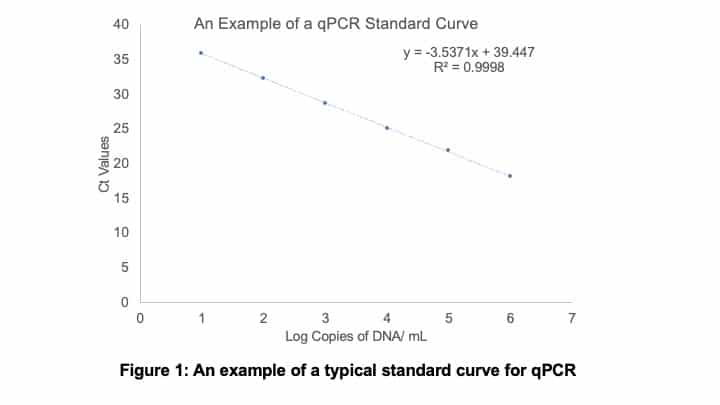
您還希望以三份形式運行示例,以便評估可重複性。
為了得到精確的結果,在每次反應中進行順序稀釋和吸除相同體積的DNA。用水代替DNA作為陰性對照來檢測反應中的汙染物和區分背景擴增。
同時,要確保你的DNA樣本是高質量的(完整的DNA,適當的濃度和良好的260/280的比例).
分析你的標準曲線
一些qPCR軟件可以用來分析你的標準曲線。它生成曲線並計算反應效率。在分析曲線時,有幾個值需要計算和評估。
聚合酶鏈反應效率
我們所說的PCR效率是什麼意思?在PCR的理想條件下,DNA分子的數量應該每循環翻一番。這將提供100%的效率,這是我們正在努力實現的目標。反應很少是完美的,因此,可接受的效率範圍在90%到110%之間。
你可能會想,哇,你怎麼能有超過100%的效率?這是可能的,通常表示聚合酶抑製。這種抑製作用在稀釋程度最低的樣品中最強。隨著樣品被稀釋,抑製劑的濃度降低(因為稀釋),這可能導致效率超過100%。
如果你確實看到效率超過100%,嚐試稀釋你的樣品更多或不包括更高的稀釋在效率計算。
如果數值低於90%,則可能存在抑製劑汙染或底漆效率較差。
如何計算PCR效率
很多qPCR軟件會為你計算PCR效率,但如果你想自己計算,你可以使用下麵的公式:
E =(10 ^{\壓裂{1}{坡}})1要得到效率百分比,隻需將這個數字乘以100。
R2價值
R2值為相關係數,應為> 0.99,以提供良好的置信度。
這個值可以讓您查看每個樣本的值之間是否存在良好的線性關係。較低的值可能表明序列稀釋程度較差。為了避免這種情況,在進行連續稀釋時,請確保您的移液管準確,使用校準好的移液管,並充分混合稀釋劑。
如何計算R2價值
要手動計算這個值,可以用每個樣本稀釋倍數與平均值的對數繪製一個圖Cq價值.Excel會計算R2值,您可以通過確保在圖表選項中選擇“在圖表上顯示方程”來查看。
Cq值的標準差
執行複製有助於減少錯誤,使您的R2PCR效率值更可靠。但是,如果您的複製變化太多,您將得不到可靠的值。
要檢查複製的可靠性,請計算標準偏差(SD)。好的重複應在0.2 SD單位以內。如果它們不是,你可能需要重做你的標準曲線。
如果你從你的qPCR標準曲線中得到很好的數據,你就會對引物的效率感到滿意!但如果標準曲線數據不太好呢?
如果你的引物效率不高怎麼辦?
令人驚訝的是,qPCR標準曲線的結果往往是不相稱的曲線;每個DNA濃度的結果都是大致相同的Ct值。這意味著引物不能有效地識別目標。
如果這種情況發生在你身上,首先,確保你的DNA樣本是幹淨的,不含汙染物。如果你的引物仍然不能有效地放大,那麼設計並訂購一對新的引物。
在過去,我嚐試解決引物效率低下的問題,以找到合適的參數(引物濃度,退火溫度等)。在我看來,它很少會帶來好的結果。
差的qPCR標準曲線可能反映低的DNA表達
不良的標準曲線可能不是由低效的引物造成的。如果你的目標在樣本中表達不好,你的標準曲線可能是不正確的。你應該驗證這個靶標是否在你正在研究的細胞類型中表達。如果你的靶點表達不好,增加用於擴增的DNA的數量。
或者,你也可以做一個預擴增步驟來增加目標蛋白的表達量,這方麵有商業工具包可用。(1)你也可以在粗細胞裂解物上進行qPCR純化RNA樣品,以避免丟失材料。(2)
qPCR標準曲線的優點
除了知道引物是否有效外,標準曲線還能告訴你檢測限。這可以幫助你確定下一步實驗中使用的DNA的合適數量。當你用1ng就能得到很好的擴增時,為什麼每次反應用10ng呢?這樣你就可以把你寶貴的DNA樣本留給更多的qPCR反應!
總而言之,跳過qPCR標準曲線步驟可能很誘人,但我希望我說服了你花時間評估你的新引物的效率是多麼重要。在開始的時候花點時間來確保你的引物是有效的,從長遠來看可以節省大量的時間,最終導致更好的結果!
最初發布於2016年11月。2022年6月審核並更新。
參考文獻
- Korenkova V等人(2015)高通量qPCR基因表達實驗背景下的預擴增.BMC雜誌。十六5。
- 範佩爾G, Mestdagh P, Vandesompele J. (2012)細胞培養裂解物精確RT-qPCR基因表達分析.Sci代表.2:222。
在我們的實驗室中,我們使用TaqMan探針進行qPCR。我們使用的PCR試劑盒沒有標準樣品,所以我們最終隻報告了Ct值的PCR結果。我想通過取患者樣本,製作當地標準樣品,並將其置於Nanodrop中進行濃度估計。這有幫助嗎?
校園裏有一台羅氏Lightcycler II。這台qPCR機器開發了檢查引物效率所需的標準曲線,引物被選擇用於[…]
我從標準曲線實驗中得到了Ct值,但我不確定如何進行分析和計算效率。我用的那個lightcycler屬於另一個實驗室,他們不建議使用上麵的軟件,所以我想知道是否有什麼好的,用戶友好的,免費的軟件我可以用它來做計算。或者如果我有Ct值,有沒有辦法手動繪製並計算效率?
謝謝,
茱蓮妮
我也像這樣進行qPCR。
這篇文章對我的實驗很有幫助。
謝謝你!
最好的問候,
Tatpong
你好,
感謝這篇文章,qPCR對初學者來說確實有困難。在我們實驗室,我們使用Taqman引物,我想知道這些引物是否也需要標準曲線?
歡呼,Feli
嗨Feli,
感謝您的評論!
對於Taqman引物,你可以做一個標準曲線,但不像SYBR綠色那麼必要。該探針使qPCR反應更具特異性和有效性。
最好的問候,斯蒂芬妮