Opentrons正在為任何實驗室提供自動化,首先是為生物學家提供價格實惠的移液機器人。憑借易於使用的硬件和開放的軟件平台,Opentrons自動化了手工實驗室工作,並為數百名生命科學家提供了協作研究的能力。前十大製藥公司中有90%的科學家使用Opentrons,前50所生物研究型大學中有90%的科學家使用Opentrons。
RNA分離故障
讚助內容Opentrons
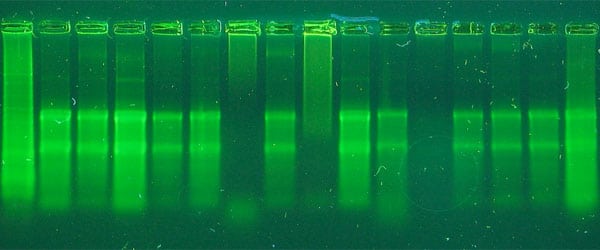
盡管RNA被廣泛使用,但分離RNA仍然是比較苛刻的協議之一。幾乎所有使用過這種技術的人都有自己的技巧和技巧,可以成功地從他們的樣本中分離出完整的RNA。盡管由於RNA的不穩定性,它在某種程度上是不可預測的,但仍有一些常見的問題可以解決。
1.問題:RNA中的基因組DNA
RNA被基因組DNA洗脫,這由高分子量塗片證明,或者它在凝膠上看起來幹淨,但-RT對照在進行PCR時擴增。
原因:不管你用什麼方法來分離RNA, DNA的痕跡總會帶過去。這是真實的TRIzol(苯酚)製劑和二氧化矽自旋過濾器。這可能是由均質化過程中基因組DNA剪切不足引起的。如果采用苯酚法,則pH值苯酚的含量是關鍵(它應該是酸性的),而你隻移液水相的技能會導致或多或少的DNA汙染。
解決方案:基因組DNA需要很好地均質化,因此使用一種方法來充分破壞DNA,如高速打珠器或polytron轉子定子。樣品在均質過程中會加熱,但在胍中冷卻樣品會導致鹽析出。所以你需要平衡均勻化的時間和冷卻到室溫的時間。
去除gDNA的最好方法是用脫氧核糖核酸酶處理,例如RTS DNase™試劑盒,含有高活性,室溫穩定的DNase,有效去除汙染的DNA。去除DNA後,使用樹脂去除DNase酶,無需加熱或EDTA。這種類型的試劑盒特別推薦用於富含gDNA的樣品(即脾髒組織),在DNase處理之前已經純化的樣品,以及當需要處理部分樣品時。“柱上”方法也可用於含有低水平gDNA汙染的樣品。
2.問題:RNA降解/完整性低
rRNA帶似乎塗抹在凝膠上,或者18s帶比28s帶更強烈。在安捷倫生物分析儀上,你可以看到一個更大的18s峰值。
原因:降解發生在加工過程中的某個時刻。這一點很難確定。它可能發生在收集和儲存過程中,也可能發生在提取過程中。也可能是在隔離後發生的。
解決方案:如果問題發生在儲存過程中,請確保樣品采集後立即冷凍。使用液氮或-80°C儲存。對於動物組織,使用RNALater,然後保存在-20°C。
如果問題發生在提取過程中,嚐試添加β -巰基乙醇(BME)到裂解緩衝液。每1ml裂解緩衝液使用10 μ l 14.3 M BME。BME將殺死rna酶,並在提取過程中幫助穩定樣品。
如果樣品是從冷凍室取出來的,並且沒有在防腐劑溶液中,不要讓它解凍。在BME存在的情況下快速均質。確保不要留下任何大塊的組織。它需要完全裂解。
RNase分離後也會發生降解。確保用於顆粒洗脫或再懸浮的水不含RNase。許多試劑盒為經DEPC處理或以其他方式純化的RNA工作提供水。更多關於DEPC治療和rna酶背後的神話可以在這裏閱讀。
此外,10種免費工作RNase的方法這篇文章也可能對你有幫助。
3.問題:RNA中的抑製劑
RNA具有異常低的260/230讀數(低於1.0)或260/280讀數,或在逆轉錄中不起作用。
原因:RNA製劑中低260/230表示胍鹽攜帶到樣品中或有機抑製劑(如腐殖酸或多糖,如果樣品是環境的)。胍鹽用於TRIzol和二氧化矽製劑中。這些鹽滅活RNA酶,但也會抑製蛋白質,如RT酶,如果存在於最終的RNA。低260/280表示蛋白質汙染。
解決方案:對於較低的260/230讀數,最好的方法是嚐試多次洗滌RNA樣本。如果這是TRIzol沉澱,試著用乙醇清洗以脫鹽。對於二氧化矽製劑,用70-80%乙醇額外清洗幾次應該可以清除柱中的鹽。對於已經純化但不幹淨的樣品,可以嚐試用乙醇沉澱RNA來脫鹽。
對於其他抑製化合物,如腐殖酸和多糖,您可能需要在另一個色譜柱上重新純化樣品,並在洗脫前充分清洗。這些化合物中的一些無法用常規方法從RNA(或DNA)中去除,因為它們與核酸過於相似。在這種情況下,您可能要考慮使用抑製劑去除技術用於環境樣品。
蛋白質結轉的260/280讀數較低,很可能是因為試劑盒或方法使用了過多的樣品。樣品淹沒了化學反應,蛋白質沒有被完全去除。試著用另一種方法清理樣品——苯酚:氯仿和沉澱,或者加入結合鹽和乙醇,結合到另一個二氧化矽自旋過濾器上。蛋白質應該很容易被去除。下次盡量少用樣品,確保均質完成。
4.問題:RNA產量低
RNA的產量比預期的要低——要麼是基於你之前的結果,要麼是基於某種組織或細胞類型的報告產量。不同培養的細胞類型和不同組織中的RNA產量差異很大。為血RNA,因人而異。
原因:如果RNA的產量低於你預期的或知道它應該是低的,並且RNA是完整的(閱讀:未降解),那麼均質化可能沒有完成。要分離RNA,強裂解是關鍵。存儲在RNALater中的組織將傾向於更難均質。低產量可能是由於組織稱重錯誤或培養細胞計數錯誤造成的。你的細胞可能比你想象的要少。對於血液RNA,顏色會根據你收集白細胞層的技巧和每個病人的情況而有所不同。
解決方案:對於RNA產量低但RNA完整的情況,重點關注均質化方法,並確保從所有細胞中獲得良好的基因組DNA剪切和RNA釋放。如果你在勻漿中看到任何組織或碎片,那就是丟失的RNA。
稱量小塊組織可能很困難,所以要確保你使用的是精確到你需要的重量的秤,否則你可能會看到不同的準備,以及其他純度問題,當使用太多時,堵塞柱。對於細胞,如果你想要一致性,有一個準確的計數是很重要的。
如果RNA看起來降解了,除了產量低之外,問題可能是均質太硬,樣品加熱時間太長。試著以30-45秒為間隔,休息30秒。確保將組織切片迅速放入冷胍裂解緩衝液(或TRIzol)中,以防止RNase在設置過程中活動。
使用二氧化矽自旋過濾器,確保色譜柱的洗脫液有足夠的體積從膜上釋放RNA。更多的水會洗脫更多的RNA,所以使用最大的體積,讓RNA像你需要的那樣濃縮。不要嚐試使用少於製造商建議的體積,否則你可能會把RNA留在膜上。如果以最大回收率為關鍵,最好在乙醇沉澱後再進行更多的洗脫和濃縮。
最後……
無論樣品來源如何,RNA的分離遵循類似的方案。對所有樣品來說,均質化是第一步,也是最重要的一步。良好的均質化需要快速破壞細胞以滅活裂解緩衝液中的rna酶,並且需要將基因組DNA的大小分解以使去除更有效。
2019年6月再版。
64條評論
留下評論
你一定是登錄發表評論。


你好,很有幫助,什麼樣的胍鹽最適合這個應用。你能告訴我們嗎,謝謝!
我從冷凍幹燥的人體活檢組織中提取RNA,我得到:g濃度在600 - 900 ng/microlit之間,260/280的比例為2。14到3.0,但在凝膠上我看不到2條帶。請建議